新型コロナワクチンとして一躍、脚光を浴びたmRNAという遺伝物質。だが、それ以前からさまざまな病気に応用すべく、多くの臨床試験が進んでいた。
医療の未来を変えると期待されるmRNA医薬開発の最前線について、京都府立医科大学大学院医学研究科の医系化学准教授・内田智士さんに聞いた。
■mRNAをつくる技術は80年代に確立されていた
――そもそもm(メッセンジャー)RNAとは、なんなのでしょう?
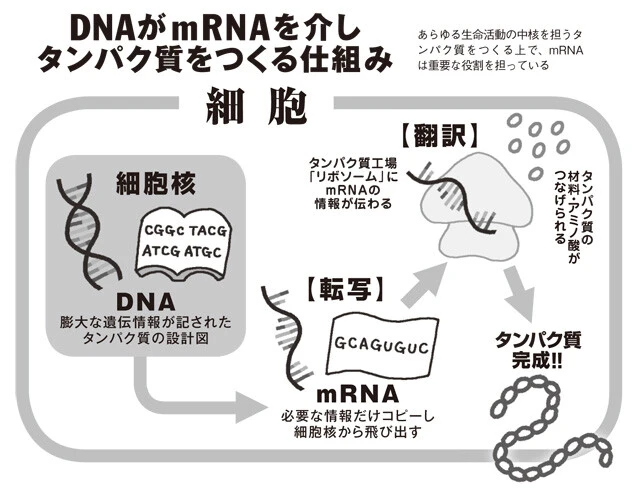
「まず、あらゆる生命現象の中核を担うのがタンパク質で、これをつくる設計図が遺伝子といわれるDNAです。
DNAが見つかったのは1870年頃とされていますが、1930年代までは何をするものなのかわからなかったようです。そして40年代にDNAは遺伝子ではないかという仮説に基づく実験が行なわれるようになり、52年にそれが確定。そして53年には、DNAの構造(二重らせん構造)が明らかになりました。
次に解明されたのがDNAがタンパク質をつくる過程で、その過程にmRNAという物質が関与することが61年に発見されます。
タンパク質は細胞内のリボソームというところでつくられますが、その際に細胞の核の中にあるDNAから、『平均10時間』という極めて短い寿命の設計図が切り出され、リボソームに送り込まれます。この短い寿命の設計図こそがmRNAです」
――DNAが直接、タンパク質をつくるわけではないのですね。なぜ、そんな回りくどいことをするんでしょう?
「DNA=分厚い辞書、mRNA=必要な部分のコピー、とイメージすればわかりやすいかもしれません。この辞書には膨大な遺伝情報が含まれているので、そのすべてを細胞核の外に持ち出すのはリスクがある。
従って、その時々に必要なタンパク質をつくるのに必要な分だけの遺伝情報を原本からコピーする(転写)。そして、mRNAの情報を基に、t(トランスファー)RNAという別のRNAがアミノ酸をリボソームに運び、タンパク質がつくられるわけです(翻訳)。
このような間接的なルートを設けることで、遺伝情報の本丸であるDNAを保護し、mRNAはその調整役を担っていると考えられています。
ちなみに、mRNAの発見は人類史上極めて重要ですが、誰もノーベル賞を受賞していません。ノーベル賞は特定の研究に関して受賞者は最大3人との規定があり、mRNAの発見は多くの研究者の発見や理論を総合したなかで実現したものなので、3人だけを選ぶのが困難なのです」
――mRNAを病気の治療に使おうという発想はいつからあったのですか?
「人工的にmRNAをつくる技術は、80年代に確立されていました。mRNAの基になるDNAの鋳型(いがた)を作製し、これにヌクレオチド、酵素といった材料を加え、目的のmRNAをつくるというものです。
90年には、人工的につくったmRNAをマウスに投与し、目的のタンパク質をマウスの体内でつくることに成功。これを機に、ヒトの病気の予防や治療への応用が期待されるようになりました」
――80年代に存在した技術が、新型コロナワクチンでようやく実用化したわけですね。
「はい。人工的につくったDNAを体内に投与すると、遺伝子を傷つける恐れがありますが、先述したようにmRNAは寿命が短いので、目的のタンパク質をつくった後は分解され、遺伝子を傷つけないという長所があります。
ただ、以前はヒトにmRNAをそのまま注射すると、即座に分解されて働くに至らなかったり、体内で免疫がmRNAを異物と認識して攻撃してしまい強い炎症が起きるなどの問題があったりして、治療には使えませんでした。
しかし2000年代に、mRNAに化学的変更を施し、脂の膜で包むなどの処置を行なうことで、分解や炎症を軽減する技術が確立されました。その技術に関連して設立されたバイオベンチャーが、今回、新型コロナのmRNAワクチンを開発した独ビオンテック社や米モデルナ社です」
■コロナ以外の感染症やがんのワクチンも
――新型コロナのほかに、mRNAはどのような治療に使える可能性がありますか?
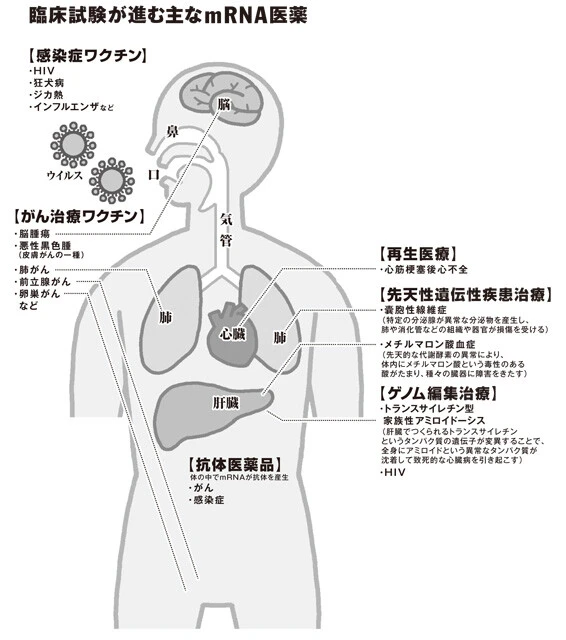
「まず感染症について言うと、新型コロナ以前から数多くの臨床試験が行なわれています。例えばHIV、狂犬病ウイルス、ジカウイルス、インフルエンザウイルスのワクチンなどです。
今後は、1歳未満の乳児突然死の原因ともなる呼吸器感染症・RSウイルス感染症のワクチンなどの開発が進展する可能性があります。乳幼児を被験者とする臨床試験は実施が難しく、新しいタイプのワクチンとなればなおさら困難が多いものですが、新型コロナでは緊急性の観点から海外で生後6ヵ月~11歳を対象とした臨床試験を実施中です。
ここで得た、とりわけ安全性に関する知見をRSウイルスワクチン開発に生かせるのではと考えています。
また、mRNAの利点は、材料であるヌクレオチドの配列の組み換えが容易な点です。つまり、ほかのウイルスに対するワクチンは、新型コロナワクチンのmRNAをほかのウイルスのものに組み換えればいい。感染症に対するmRNAワクチンは新しいものが次々に出てくる可能性があります」
――感染症のほかに応用できる治療はありますか?
「現在、ヒトでの臨床試験が最も盛んに行なわれているのは『がんワクチン』です。これは予防目的ではなく、すでに発症した人への免疫治療に使われます。対象となるがんは主に皮膚がんの一種である悪性黒色腫、前立腺がん、脳腫瘍などです。
がんは、無限に増殖するがん細胞が正常細胞を駆逐してヒトを衰弱死に追いやります。がん細胞はヒトの体にとって異物なので、本来なら免疫細胞が排除するはずですが、がん細胞はこの免疫細胞の攻撃を阻止する働きを持っています。
この働きを抑えることに成功したのが、京都大学の本庶佑(ほんじょ・たすく)教授が18年にノーベル生理学・医学賞を受賞した研究を基に開発された、『免疫チェックポイント阻害薬』でした。
一方、mRNAのがんワクチンは、がん細胞を攻撃する免疫細胞を増やします。mRNAを投与することで、がん細胞の表面に特有なタンパク質が体内でつくられ、それに免疫が反応していく。この『訓練』により、狙ったがん細胞のみを攻撃する免疫細胞を増やすという仕組みです」
――基本的には新型コロナワクチンと同じ仕組みですね。
「そうです。ただし、がん細胞は長年かかって生成され、その組織は均一でなく多様なため、特有のタンパク質が見つからないこともあります。その場合は、個々の患者のがん細胞を採取して遺伝子解析をし、がんを起こす遺伝子変異と、それに伴ってできるタンパク質を見つけ出し、対応するmRNAを投与して免疫細胞の攻撃力を高める手法も研究されています」
――いわば"オーダーメイド"のがんワクチンですね。その実現は近いんですか?
「現時点では、多くは初期段階です。初のがんワクチン実現には、今後5~10年はかかると私はみています。また、先述したように、がん細胞には免疫細胞を阻止する機能があるため、ワクチンで免疫細胞を強化しただけでは治療効果が十分とはいえません。
そのため、臨床試験の多くは、『免疫チェックポイント阻害薬』を併用しながら、ワクチンで強化した免疫細胞ががん細胞を攻撃するという二段構えで実施されています」
■ゲノム編集で遺伝性疾患にも効果
――がんや、感染症のワクチン以外ではいかがでしょう?
「一般の方が医薬品と聞いて思い浮かべるのは化学合成された経口薬だと思いますが、医薬品の全世界売上高においては、現在トップ10の多くを占めるのが、人工的につくり出した抗体を注射で投与し、病気の原因となるタンパク質の働きを抑える『抗体医薬品』です。
抗体医薬品もタンパク質でつくられていますが、生産に高い技術が必要なため非常に高価なことが課題でした。これを解決するため、抗体医薬品の基になるmRNAをヒトに投与し、体内を"工場"代わりにして抗体をつくり出すことでより安価な治療を実現する試みが始まっています。
また、mRNAを用いた『ゲノム編集治療』も注目されています。病気の原因である異常な遺伝子を切り取ったり、書き換えたりすることができ、一度の治療で永続的な効果が期待されています。
今年7月、アメリカ、イギリス、ニュージーランドの研究チームが、『トランスサイレチン型家族性アミロイドーシス』を対象とする臨床試験の結果を発表しました。
この病気は、肝臓でつくられるトランスサイレチンというタンパク質の遺伝子が変異することで、全身にアミロイドという異常なタンパク質が沈着して致死的な心臓病を引き起こす遺伝性疾患ですが、たった一度の静脈注射で異常なトランスサイレチンの血中濃度が治療前に比べ8割も減少するという、従来では考えられなかった効果が示されたのです。
そのほか、再生医療などでも臨床試験は進んでおり、mRNAが医療の"ゲームチェンジャー"になる可能性は十分にあるでしょう」